








 |
 |
Cultivo de fibroblastos autólogos
1. Objetivo
El objetivo del presente documento es describir las técnicas a emplear en el aislamiento y expansión de fibroblastos a partir de biopsia de tejido dérmico.
2. Procedimiento: Background quirúrgico
Aprobado el diagnóstico y la indicación
de esta terapia para el paciente por parte de los médicos responsables
se realiza en primer lugar una biopsia de piel, de la parte posterior
de la oreja, a partir del cual se aislarán células para
iniciar los cultivos.
Este material será entregado al laboratorio en un recipiente
(tubo Falcon de 50 ml) con medio de transporte estéril para su
posterior procesamiento.
El tubo deberá ser rotulado con el nombre del paciente y la fecha
y hora de la biopsia. Al material de la biopsia deberá adjuntarse
el formulario con los datos del paciente, lugar y hora de la biopsia,
resultados de tests virales (HIV y hepatitis) así como la dirección
del centro médico referente y el nombre del cirujano.
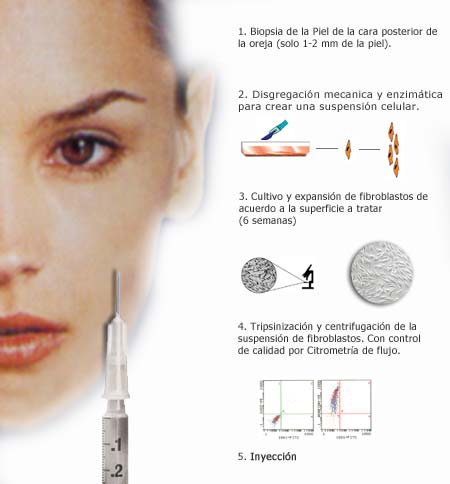
2.1. Aislamiento y expansión celular
En el laboratorio (clean room), bajo una campana
de flujo laminar, se extrae el material de la biopsia en forma estéril
y se transfiere a una placa de Petri.
Con ayuda de pinza y escalpelo se disgrega la muestra cutánea y
se sumerge en una solución de colagenasa.
Luego de la digestión enzimática la suspensión es
filtrada y sembrada en frascos de cultivo en el medio correspondiente.
El cultivo se incuba a 37ºC en atmósfera de 5% CO2 y se mantienen
realizando dos cambios del medio semanalmente. Cuando las células
llegan a confluencia el cultivo es repicado. Este procedimiento se repite
tantas veces como sea necesario hasta alcanzar el número de células
requerido. Una vez alcanzado el número de células se le
informará al médico referente.
Las células serán resuspendidas en medio de transporte y
serán enviadas al centro médico correspondiente en un tubo
rotulado con los datos del paciente dentro de una caja acondicionada a
tal fin.
3. Test de control de proceso
3.1. Recuento de células y evaluación
de viabilidad con azul de Tripan
Se toma una alicuota de la suspensión celular
y se mezcla con el mismo volumen de una solución de azul de Tripan.
Contar las células en cámara de Neubauer.
Las células viables no toman el colorante, mientras que las células
muertas se tiñen de azul, por lo tanto pueden diferenciarse y de
este modo obtener el porcentaje de células viables.
3.2. Análisis por citometría
de flujo
Luego de recontar las células se resuspenden
aproximadamente 500.000 células en 700 µl de PBS.
Pipetear 100 µl de la suspensión celular en tubos apropiados
para el análisis por citometría de flujo conjuntamente con
5 µl de anticuerpo específico ( anti colágeno humano).
Incubar 15 minutos a 4ºC.
Agregar 2 ml de PBS y centrifugar 10 minutos a 600 g (1.200rpm).
Descartar el sobrenadante y resuspender las células en 200 ml de
PBS.
El resultado será analizado empleando el sofware “System
II” en un citómetro Coulter EPICS XL.
3.3. Controles bacteriológicos y de
Micoplasmas
Tanto el medio de transporte en el que arriba
el material de la biopsia al laboratorio como el medio de cultivo correspondiente
a la última cosecha celular serán sometidos a análisis
bacteriológico y de micoplasmas para evaluar su esterilidad.
4. Transporte
El día de la cirugía las células
cosechadas de los frascos de cultivo deben ser resuspendidas en 200 µl
de medio de transporte. Transferir la suspensión celular a una
ampolla de transporte que deberá ser etiquetada con los datos del
paciente, el número de células y la fecha de vencimiento
del material.
Las ampollas de transporte serán colocadas en una caja con elementos
enfriantes y transportada al centro médico correspondiente acompañada
de un formulario. Este formulario deberá ser completado y la copia
1 será entregada al centro médico y la copia 2 será
remitida al laboratorio para su archivo.
5. Documentación
Los resultados del control del proceso deben ser volcados
a las planillas correspondientes y enviados junto al producto.
La documentación de los ensayos bacteriológicos se archivará
en el laboratorio en la carpeta correspondiente a cada paciente.
El resultado de la inmunomarcación será enviado junto al
producto celular para el implante y se archivará una copia en la
carpeta del paciente.
Agrelo
3038 - C.P. 1221/Buenos Aires / Argentina - Teléfono/Fax:
(+54-11) 4932-7068/4956-1579 - mail: info@cellprep.com (c) 2000 CellPrep S. A. Todos los derechos reservados. |
||||