








 |
 |
antígenos tumorales para vacunas | aplicaciones clínicas | perspectivas futuras |
bibliografía |
Una de las dificultades para el uso clínico de las CD radica en la obtención de cantidades suficientes de células debido a que en la sangre representan solo el 0.1% de los leucocitos y a que en el estadío inmaduro las células no poseen la capacidad de multiplicarse.
Recientemente se demostró que las CD pueden
ser expandidas directamente in vivo. La administración del ligando
de Flt3 durante 10 días produjo un incremento de 20 veces el
número de CD circulantes en pacientes con cancer de colon (15).
Esta estrategia podría constituirse en otra alternativa viable
para la obtención de cantidades adecuadas de CD para la producción
de vacunas autólogas.
Valone y col. (16) emplean CD circulantes en sus protocolos clínicos.
Han demostrado que las CD obtenidas por procedimientos de aféresis
y posteriores purificaciones en gradientes de diferentes densidades,
maduran espontaneamente in vitro en medio libre de suero y citoquinas.
Sin embargo, hasta el presente la mayoría de los experimentos
pre-clínicos y protocolos de vacunación se han llevado
a cabo con CD obtenidas in vitro. Las dos fuentes celulares más
frecuentemente empleadas como población de partida para la generación
de cantidades adecuadas de CD maduras in vitro son: células progenitoras
CD34+ (17, 18) y monocitos CD14+ (19, 20). (ver
Figura 4)
Los monocitos pueden ser diferenciados a CD inmaduras
por el agregado de la combinación de GM-CSF e IL-4 al medio de
cultivo, mientras que la mayoría de los protocolos para producir
CD a partir de células CD34+ incluyen el agregado de citoquinas
adicionales como SCF y el ligando de Flt3.
La obtención de CD maduras se logra con la posterior adición
de un estímulo como el cross-linking con CD40 (21), patógeno
(22), LPS (23), ADN (24), proteínas de "heat shock"
(25) y citoquinas como el cocktail definido por Jonuleit que incluye
TNF-a, IL-1, IL-6 y PGE-E2 (26).
En nuestro laboratorio el empleo de TNF-![]() como única citoquina de maduración ha mostrado ser muy
efectivo. Fenotipicamente las CD maduras se definen por la expresión
de marcadores de maduración como el CD83 y el aumento de la expresión
de moléculas coestimulatorias como el CD80 y CD86. Considerando
las células cuyo fenotipo es CD14-, HLA-DR++, CD86+, CD1a, CD83+
hemos obtenido un promedio de 88% de células dendríticas
maduras (ver Tabla 1). Las
CD fueron obtenidas a partir de monocitos. Puede observarse el perfil
de expresión de marcadores de superficie en cada una de las muestras
cultivadas.
como única citoquina de maduración ha mostrado ser muy
efectivo. Fenotipicamente las CD maduras se definen por la expresión
de marcadores de maduración como el CD83 y el aumento de la expresión
de moléculas coestimulatorias como el CD80 y CD86. Considerando
las células cuyo fenotipo es CD14-, HLA-DR++, CD86+, CD1a, CD83+
hemos obtenido un promedio de 88% de células dendríticas
maduras (ver Tabla 1). Las
CD fueron obtenidas a partir de monocitos. Puede observarse el perfil
de expresión de marcadores de superficie en cada una de las muestras
cultivadas.
Una vez obtenidas las CD se procede a "cargarlas"
o "pulsarlas" con el antígeno de interés. Los
antígenos intracelulares originados por ejemplo de virus o microorganismos
que viven intracelularmente son principalmente presentados por moléculas
de CMH clase I. Estos son reconocidos por linfocitos CD8+ citotóxicos
dando como resultado la activación de una respuesta inmune predominantemente
mediada por células.
En el caso de antígenos que se originan de patógenos extracelulares
y que penetran a la célula por fagocitosis o pinocitosis la situación
es diferente. Estos antígenos son presentados por moléculas
CMH clase II que son reconocidas por linfocitos T CD4+, proceso que
origina la activación de una respuesta predominantemente humoral.
Dependiendo de la estructura del antígeno y del tipo de respuesta
inmune deseada se emplean distintos estadíos madurativos de las
CD (27).
Se han descripto tres estrategias de carga antigénica para su
aplicación clínica:
• Carga con ADN
Este método se basa en insertar genes de antígenos en el genoma de las CD. Los antígenos pueden ser incorporados como ADN que luego es transcripto y traducido por la misma célula. La proteína producida es degradada durante el proceso de metabolismo normal celular. Los péptidos así generados pueden ser cargados en moléculas de CMH y presentados en la superficie celular.
Se han empleado vectores no virales (lípidos catiónicos, partículas de oro cubiertas con plásmidos) para insertar en las CD genes de antígenos asociados a tumor (MART-1, tirosina, MUC-1) (28). La desventaja de este método es una eficiencia de transfección inconsistente (entre 5-95%). En cuanto a vectores virales, los más comunmente empleados son retrovirus y adenovirus y en algunos casos herpes y POX.Para la transfección con retrovirus se requieren células en proliferación por lo que su uso está restringido a la obtención de CD a partir de progenitores CD34+, mientras que para el empleo de vectores adenovirales es posible transfectar células diferenciadas como CD inmaduras o CD maduras (29). Se ha observado que el adenovirus no altera las propiedades morfológicas, fenotípicas y funcionales de la CD.
La ventaja de este método radica en que el antígeno es expuesto directamente en el citoplasma y en consecuencia presentado vía moléculas del CMH clase I, activandose a los linfocitos T CD8+ citotóxicos que son necesarios por ejemplo para erradicar las células tumorales.
• Carga con antígenos específicos de patógenos o tumores
Debido a que solamente se han identificado antígenos
específicos para una minoría de tumores, numerosos estudios
han reportado el empleo de lisados de células tumorales o proteínas
específicas de patógenos. Las células de elección
para esta estrategia son las CL, debido a que se requiere una activa
internalización del antígeno.
Los péptidos obtenidos como producto de la degradación
de las proteínas dentro de los endosomas son principalmente cargados
en moléculas CMH clase II. De este modo, Chakraborsty y col.
(30) describieron la inducción de linfocitos T citotóxicos
in vivo en pacientes con melanoma.
Recientemente se han realizado estudios empleando
células apoptóticas de tumor como fuente antigénica.
La internalización de células apoptóticas por las
CD es muy eficiente. Además Albert y col. (9) demostraron una
presentación cruzada antigénica no solamente sobre moléculas
de CMH clase II sino también sobre clase I.
Una estrategia diferente que también emplea células tumorales
es el uso de híbridos de tumor-CD generados por electrofusión
o tratamiento con polietilen-glicol. Se ha descripto la obtención
de hasta un 20% de híbridos que muestran un fenotipo comparable
al de las CD y que representarían a una célula tumoral
que ha adquirido las características coestimulatorias de una
CPA. Kugler y col. (31) han empleado estos híbridos en ensayos
clínicos en pacientes con carcinoma renal.
La desventaja de estas estrategias que emplean células tumorales como fuente de antígenos radica en la posibilidad de que los antígenos presentados a las CD incluyan no solamente a aquellos del tumor, sino también a antígenos de tejidos normales. Cabe la duda, entonces, de que pueda inducirse autoinmunidad. No obstante, ningún caso de desarrollo de una enfermedad autoinmune de novo ha sido descripto hasta el presente.
• Carga con péptidos específicos del tumor
Una estrategia promisoria en la que se emplean CD
maduras es el uso de péptidos específicos obtenidos por
síntesis que son cargados directamente sobre las móleculas
de CMH de superficie. La ventaja de este método es el empleo
de antígenos bien definidos lo que reduce la posibilidad del
desarrollo de un proceso autoinmune y reactividad cruzada y facilita
el monitoreo tanto in vitro como in vivo de la respuesta obtenida.
La desventaja de este método es su limitación a tumores
con antígenos definidos (por ej.: melanoma, carcinoma de próstata,
mieloma múltiple), su restricción a determinadas clases
de HLA, resultando en la exclusión de un número significativo
de pacientes de este tipo de tratamiento y la inducción de un
repertorio de células T restringido menos adecuado para controlar
una variación antigénica tumoral.
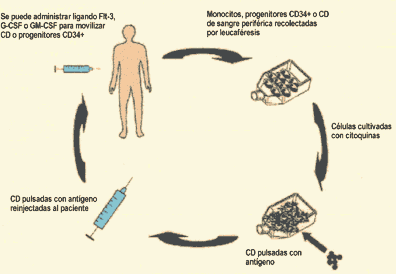
Se obtienen monocitos por
leucaféresis y luego sigue un período de cultivo in vitro
con citoquinas.
Las CD pueden estar condicionadas con un estímulo de activación
o
maduración, y luego se les carga el antígeno (la vacuna),
antes de ser reinfundidas , en general en forma endovenosa o intradérmica.
En algunos protocolos, las CD preparadas se congelan para vacunaciones
posteriores, y en otros son generadas en el momento de comenzar el ciclo.
|
Muestras |
Células Totales |
Células dendríticas |
% de Diferenciación |
| 1 |
1.9 |
1.22 |
64.4 |
| 2 |
1.10 |
1.08 |
98.5 |
| 3 |
1.10 |
1.07 |
97.8 |
| 4 |
6.47 |
6.37 |
98.5 |
| 5 |
4.43 |
3.71 |
83.8 |
| 6 |
5.25 |
4.40 |
83.9 |
7 |
3.20 |
2.07 |
64.8 |
8 |
2.40 |
2.31 |
96.6 |
9 |
3.90 |
3.48 |
89.3 |
10 |
8.10 |
6.45 |
79.7 |
11 |
10.60 |
7.54 |
71.1 |
|
|||
[volver]
Agrelo
3038 - C.P. 1221/Buenos Aires / Argentina - Teléfono/Fax:
(+54-11) 4932-7068/4956-1579 - mail: info@cellprep.com (c) 2000 CellPrep S. A. Todos los derechos reservados. |
||||